Research Progress
薛婧研究组揭示组蛋白甲基化酶SETD2协同Kras调控胰腺癌发生发展
Date:2019-07-24胰腺癌被称为“癌中之王”,恶性程度高、发展和恶化速度快,确诊时多为晚期,且至今没有特别有效的治疗方法,从而具有较高的死亡率。因此针对其发病机制的研究极为迫切。表观调控异常是恶性肿瘤的重要特征之一,近年来已发现胰腺肿瘤中也大量存在表观修饰异常,但相关机制和功能研究仍比较欠缺。
组蛋白甲基转移酶SETD2(SET domain-containing protein 2),是目前已知H3K36me3形成的唯一三甲基化酶。目前已知SETD2/H3K36me3主要功能包括参与DNA损伤修复,维持染色质活跃状态、协助转录延伸从而促进基因转录水平。血液肿瘤、胃肠道间质瘤、结肠癌、神经胶质瘤、乳腺癌等中均发现SETD2的突变和其抑癌功能,可见SETD2-H3K36me3是肿瘤中常见的一种抑癌机制,但调控机制具有肿瘤组织的特异性。已有二代测序发现胰腺癌患者同样携带一定比例的SETD2突变,然而其在胰腺肿瘤中的功能和机制尚未明确。

2019年7月11日,上海交通大学医学院附属仁济医院薛婧课题组在GUT杂志上发表了题为“Loss of Setd2 promotes Kras-induced acinar-to-ductal metaplasia and epithelia-mesenchymal transition during pancreatic carcinogenesis”的研究工作,证实了SETD2缺失协同KRAS促进胰腺癌发生发展,并阐明了SETD2在胰腺癌起始和转移两个阶段的不同功能和机制。
90%以上的胰腺癌由外分泌细胞产生,即为胰腺导管腺癌(Pancreatic ductal adenocarcinoma, PDAC)。起始和转移是PDAC发生发展过程中最重要的两个阶段。炎症和Kras突变均可导致腺泡导管化生(Acinar to Ductal Metaplasia,ADM),且在Kras持续激活的情况下不可逆进展。目前ADM被认为是PDAC起始的重要事件。在抑癌基因失调或炎症、毒性等刺激的情况下,癌前病变的导管样细胞会进一步进展为PDAC。胰腺肿瘤容易发生远端转移,是胰腺癌患者死亡的主要原因。上皮间质化(Epithelial-Mesenchymal Transdifferentiation,EMT)是癌细胞转移的第一事件。结合共用数据库和本院临床样本,我们发现SETD2和H3K36me3表达与胰腺癌患者预后显著负相关。通过构建胰腺特异性敲除Setd2,以及联合Kras突变的小鼠,发现SETD2缺失可以大大促进KRAS诱导的胰腺癌进程。分别对腺泡细胞以及胰腺癌细胞Setd2野生型和Setd2缺失的样本进行表达谱和H3K36me3 ChIP联合分析,研究者发现两个病理阶段中,Setd2通过调控不同下游基因而发挥作用:1)起始阶段-调控MYC蛋白的E3泛素连接酶Fbxw7表达,影响腺泡细胞稳态,从而促进ADM发生;2)转移阶段:调控Ctnna1粘连蛋白的表达,影响E-cadherin稳定性,从而促进EMT及转移。
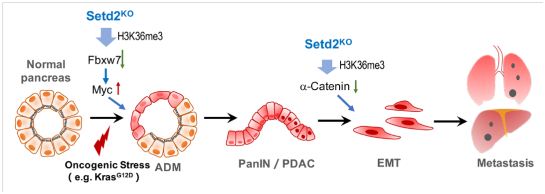
不同病理时期的差异性调节机制,赋予Setd2在复杂疾病中的不同生物学功能,从而更加精准的调控病理过程。本研究首次揭示了SETD2-H3K36me3表观调控元件协同Kras突变在胰腺癌中的功能与分子机制,深入了我们对其病理机制的认识,为胰腺癌靶向治疗提供了新的思路。
薛婧课题组的牛宁宁副研究员和博士后路平博士为该论文的共同第一作者;薛婧研究员、李力副研究员和孙勇伟主任为该论文的共同通讯作者。
原文链接:
http://dx.doi.org/10.1136/gutjnl-2019-318362
