Research Progress
刘永忠课题组在免疫调节机制研究方面取得新进展
Date:2018-10-24近日,上海交通大学医学院附属仁济医院上海市肿瘤研究所癌基因及相关基因国家重点实验室刘永忠课题组在国际学术期刊《自然通讯》(Nature Communications, IF=12.353)以及《细胞死亡和分化》(Cell Death & Differentiation, IF=8.000)上在线发表两篇论文, 首次揭示了去泛素化酶POH1调控pro-IL-1β成熟剪切、影响调节性T细胞发育生成,在维持机体产生适度的炎症反应和免疫稳态建立中发挥重要作用。

机体清除致病微生物和组织损伤修复依赖于炎症小体(inflammasome)的活化及相关炎症因子的产生;不可控的炎症小体活化相关炎症导致肿瘤、神经退行性疾病、代谢性疾病的发生和发展。为避免过度的炎症小体活化、维持机体的免疫稳态,机体中存在着针对炎症小体活化的负调控机制,但相关认识仍不十分清楚。
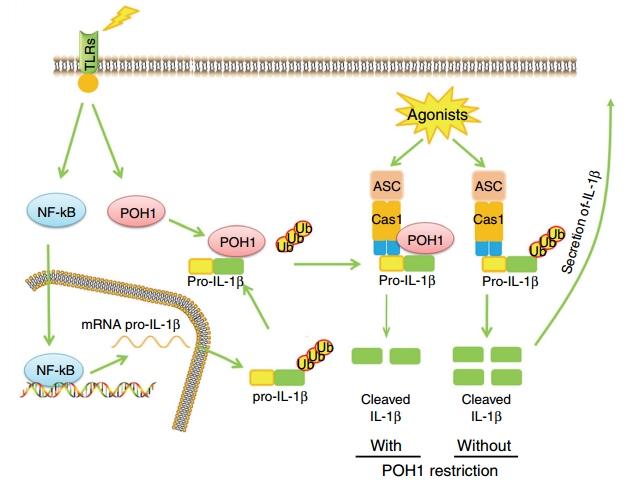
刘永忠课题组研究发现, TLR3/4信号可促进巨噬细胞中POH1蛋白的表达;利用髓性细胞特异性敲除POH1鼠的工作表明,POH1负调控NLRP3炎症小体介导的炎症反应;在分子机制上,POH1结合pro-IL-1β,剪切下调该蛋白的K63-泛素链修饰,从而抑制IL-1β的成熟及释放。该研究揭示,POH1是新的固有免疫的负调控分子,在预防炎症小体诱发的过度炎症反应中起关键作用。该研究以题为 “POH1 deubiquitinates pro-interleukin-1β and restricts inflammasome activity”发表在Nature Communications杂志;文章第一作者为上海市肿瘤研究所助理研究员张力和刘昀,通讯作者为刘永忠研究员。
该课题组的另项研究表明,POH1在Foxp3表达的CD4调节性T细胞(CD4+Foxp3+Treg)发育和生成中发挥重要作用。Treg细胞是机体维持免疫稳态的重要T细胞亚群,Treg细胞的功能和/或数目的异常和自身免疫病、肿瘤等疾病的发生、发展密切相关。研究发现,T细胞中敲除POH1可影响成熟T细胞发育、 特别是CD4+Foxp3+Treg细胞的生成;POH1缺失抑制CD25+Treg细胞前体向Foxp3+ Treg细胞分化,并下调IL-2-STAT5 信号强度。在已生成的CD4+Foxp3+Treg细胞中敲除POH1,可显著减少外周Treg细胞数目并导致致命性的自身免疫反应。该研究以题为 “Requirement for POH1 in differentiation and maintenance of regulatory T cells”发表在Cell Death & Differentiation杂志;文章第一作者为助理研究员刘昀和张力,通讯作者为刘永忠研究员。
上述研究得到了国家自然科学基金、“科技创新行动计划”青年科技英才扬帆计划项目和上海市卫生和计划生育委员会基金的资助。
