Research Progress
我所张志刚团队和仁济医院夏强团队合作在《Gastroenterology》发表肝癌研究最新成果
Date:2018-07-24近日,上海交通大学医学院附属仁济医院上海市肿瘤研究所“癌基因及相关基因国家重点实验室”张志刚研究组和肝外科夏强副院长共同带领团队在国际著名的医学杂志《胃肠病学》(Gastroenterology)在线发表题为“Overexpression of Rac GTPase activating Protein 1 Contributes to Proliferation of Cancer Cells by Reducing Hippo Signaling to Promote Cytokinesis”的研究论文,首次揭示了Rac-GTP酶激活蛋白1(RACGAP1)是人类癌症中普遍表达上调并控制肿瘤细胞生长的关键基因,证明了RACGAP1通过调控Hippo通路促进肝癌细胞胞质分裂和生长的分子机制,对肝癌的进展机制提出了新的理论,为肝癌的靶向治疗提供了新的思路与潜在靶标。
肿瘤细胞的一个重要特征是细胞周期的异常。传统的靶向微管蛋白(Microtubules)的化疗药物虽然能有效杀死肿瘤细胞,但存在严重的毒副作用。目前较新的靶向细胞分裂(如Aurora kinases, motor proteins, SAC proteins)的药物在实体瘤临床试验中的效果却很不理想。近年来的一些研究显示靶向肿瘤细胞分裂后期(Anaphase)特别是胞质分裂(Cytokinesis)可能是一个更有效的治疗策略,但是肿瘤细胞胞质分裂过程中有哪些关键的调控蛋白发挥作用以及作用机制目前尚不清楚。
肝脏组织有一个显著的特征—肝脏细胞的双核或多核性。成人体内约有≤50%的肝细胞是具备正常生理功能的双核细胞。双核的形成大多由于胞质分裂失败所致。而肝癌细胞绝大多数是双倍体细胞,其增殖高度依赖于胞质分裂。这些背景提示抑制胞质分裂很有可能抑制肝癌细胞生长而不影响正常的肝细胞功能。
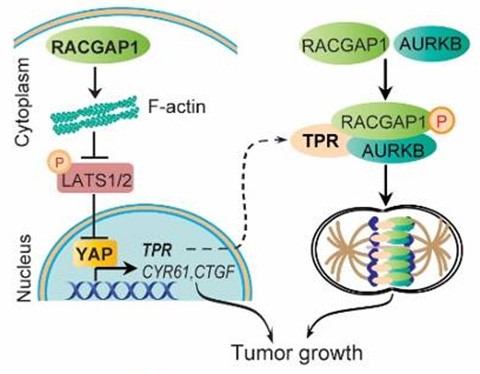
研究者利用Oncomine数据库发掘人类癌症中普遍表达上调的基因,发现胞质分裂相关蛋白变化最为显著,其中排在第一位的是RACGAP1。该研究进一步深入研究发现RACGAP1通过调节RhoA-F-actin-Hippo信号轴激活转录辅助因子YAP而促进肿瘤细胞的胞质分裂和增殖生长。作者还首次揭示了YAP能调控核孔相关蛋白TPR的表达;在细胞分裂过程中,核膜解体后,TPR能与RACGAP1和Aurora kinase B形成复合物,促进RACGAP1的磷酸化及中间纺锤体定位,促进胞质分裂和肿瘤生长。
鉴于RACGAP1在胞质分裂上的独特功能,以及肝细胞对抑制胞质分裂的可容忍性,RACGAP1有望成为肝癌治疗的新靶标。
文章的通讯作者为张志刚研究员和夏强副院长。第一作者为肿瘤所助理研究员杨小妹,硕士研究生曹萧衍和何平。该课题得到了国家自然科学基金、上海市自然科学基金和上海市卫生和计划生育委员会的资助。
